Vanesa Tella Ríos
Diplomada en Enfermería
Hospital de Cabueñes
Resumen
El paciente renal crónico precisa de una estricta dieta y de un control de la ingesta de líquidos. Para ello en las consultas de predialisis, esto es, meses antes de que la función renal del paciente precise de sesiones de hemodiálisis, se entrena al paciente y a la familia a llevar un buen control de la dieta y de la ingesta de líquidos.
En esta revisión se analizará los factores más importantes a tener en cuenta en la dieta del paciente renal así como una pincelada de las diferentes formas de dialisis que se pueden dar.
The chronic renal patient requires a strict diet and control of fluid intake. To do this in the predialisis consultations, that is, months before the patient’s renal function requires hemodialysis sessions, the patient and the family are trained to have a good control of the diet and fluid intake.
In this review we will analyze the most important factors to take into account in the diet of the renal patient as well as a brushstroke of the different forms of dialysis that can occur.
PALABRAS CLAVE: Hemodiálisis, dieta, paciente renal, insuficiencia renal crónica.
Introducción
La ERC se define como el descenso de la función renal expresada por una tasa de filtrado glomerular estimado (TFGe) menor a 60 ml/min/1,73 m2 y/o como la presencia de alteraciones en la estructura renal persistentes al menos 3 meses, con implicaciones para la salud.1 Es necesaria la persistencia del daño para diferenciar de enfermedad renal aguda. Los criterios definidos por las guías KDOQI (Kidney Disease Quality Initiative) (National Kidney Foundation, 2002) se mantienen en las siguientes guías, NICE (NICE, 2014) y canadienses (Levin A, 2008), U.S. Preventive Services (Moyer VA, 2012) y KDIGO 2012 (KDIGO, 2013) y los comentarios de estas últimas en las KDOQI (Inker L, 2014) y canadiense (Akbari A, 2015), añadiendo un criterio más, la historia de trasplante renal.2
La mayoría de personas con enfermedad renal crónica en un estadio inicial (estadios 1, 2 y 3a) apenas presentan síntomas o únicamente muestran síntomas muy inespecíficos de esta patología, lo cual dificulta la detección de la Enfermedad renal crónica.
Estadio 1. En el estadio 1 de la enfermedad renal crónica, la filtración glomerular se encuentra en un nivel normal o superior a los 90 ml/min.
El estadio 1 es la forma más leve de Enfermedad renal crónica y puede pasar desapercibida debido a que las personas que la padecen no presentan ningún signo o síntoma.
Estadio 2. Las personas que se encuentran en el estadio 2 presentan un daño renal que provoca una reducción de la filtración glomerular, que se sitúa entre los 60 y los 89 ml/min. Incluso en este estadio, es habitual no observar síntomas que indiquen el daño renal.
Estadio 3a. Quienes se encuentran en el estadio 3 de la Enfermedad renal crónica presentan un daño renal moderado. El estadio 3 se divide en:
Estadio 3a: la filtración glomerular disminuye a un nivel comprendido entre los 45 y los 59 ml/min. Ocurre a menudo que, incluso en esta fase, el paciente no experimenta síntomas que indiquen el daño renal.
Estadio 3b: forma parte de la fase terminal.
En los estadios avanzados de la enfermedad renal crónica (3b, 4 y 5), el funcionamiento de los riñones se ve gravemente reducido. Dado que los riñones han perdido la capacidad de desempeñar todas las funciones importantes, se acumulan en la sangre, un exceso de líquido y de productos de desecho. Esta patología recibe el nombre de uremia.
En el estadio avanzado de la Enfermedad renal crónica es importante hacer todo lo que esté a nuestro alcance para ralentizar la progresión hasta que se produzca la insuficiencia renal total.
Cuando el riñón falla, la función del riñón se reduce a menos de entre el 10 y el 15 % de la función renal normal.
Esta pérdida de la función renal debe sustituirse mediante diálisis o mediante un trasplante de riñón. La medida exacta de filtración glomerular que indica el momento en que se debe empezar la diálisis depende de numerosos factores como, por ejemplo, la enfermedad renal subyacente, la malnutrición, los síntomas urémicos, etcétera.
Estadio 3b. El estadio 3 de la Enfermedad renal crónica se divide en el 3a y el 3b. El estadio 3b pertenece al estadio avanzado de la ERC.
Los pacientes que se encuentran en el estadio 3b de la ERC presentan un daño renal moderado y la FG es de entre 30 y 44 ml/min.
Entre los síntomas habituales que pueden aparecer en este estadio de la Enfermedad renal crónica figuran:
-La disminución de glóbulos sanguíneos
-La malnutrición
-El dolor óseo
-El hormigueo o adormecimiento de los nervios
-Dificultades para concentrarse
-Una disminución de la sensación de bienestar
Estadio 4. En esta fase el riñón presenta un daño avanzado debido al cual la filtracón glomerular es de únicamente entre 15 y 30 ml/min. Además de los síntomas citados en la fase 3b, algunos de los síntomas más frecuentes en el estadio 4 son:
-Las piernas inquietas
-El picor en la piel
-La anemia. La anemia indica que el paciente presenta una escasez de glóbulos rojos, la cual puede provocar fatiga, dificultades para concentrarse, pérdida de apetito, hinchazón (sobre todo en las piernas y alrededor de los ojos), disnea y palidez.
Estadio 5. En el estadio 5 de la Enfermedad renal crónica el daño renal provoca una disminución de la filtración glomerular hasta situarse en 15 ml/min o menos. Los riñones han perdido casi toda su capacidad de funcionar de manera eficiente.
En este caso, la enfermedad renal ha reducido las funciones de los riñones a un nivel en el que es necesario aplicar un tratamiento de sustitución renal.
La hemodiálisis es el método más común para tratar la insuficiencia renal avanzada y permanente y se realiza haciendo pasar la a través de un filtro exterior que se encuentra en una maquina de diálisis. Este filtro permite que las toxinas y el exceso de líquido salgan de la sangre sustituyendo de esta forma la función de los riñones enfermos.
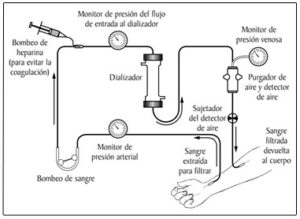
Ilustración sobre funcionamiento de hemodialisis.
Existen dos modalidades de hemodiálisis: hospitalaria y domiciliaria.
En ambos casos el tratamiento es intermitente y por lo tanto permite la acumulación de sustancias tóxicas y líquido entre diálisis y diálisis, por lo que es preciso mantener unas restricciones de dieta y líquidos.
La hemodiálisis hospitalaria, se realiza en unidades hospitalarias o centros de hemodiálisis, por lo general se realiza 3 veces por semana con una duración media de 4 horas, en turnos de Martes, Jueves y Sábado o Lunes, Miércoles y Viernes y en horario fijo de mañana o tarde. En este caso, la diálisis la realiza el personal sanitario, con el que el paciente mantiene un contacto estrecho, así como con el resto de pacientes. El paciente mantiene una actitud pasiva durante el tratamiento, pero debe de cumplir las recomendaciones dietéticas y de medicación.
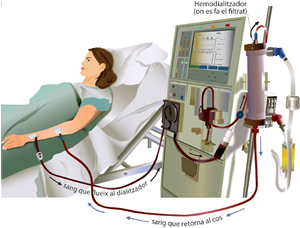
Foto de sesión hemodiálisis hospitalaria, extraída de terapia en hemodialisis.com
La hemodiálisis domiciliaria, es la que se realza en el propio domicilio tras un entrenamiento en el hospital de 1-2 meses. Sólo se desplaza al Hospital para revisiones y pruebas cada 2-3 meses. En el domicilio precisa de espacio suficiente para la maquina de diálisis y el material necesario y debe de haber un colaborador entrenado (por lo general un familiar) que deberá permanecer en el domicilio mientras se realiza la diálisis.
Actualmente en España la hemodiálisis domiciliaria tiene un desarrollo escaso, alcanzando tan solo el 0,3% del total de los pacientes en diálisis.
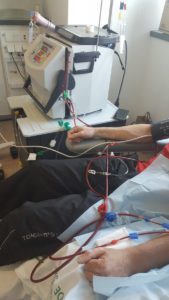
Foto: paciente en sesión de hemodiálisis domiciliaria.
Una vez sabemos como funciona la hemodiálisis es importante que el paciente adquiera un correcto manejo de la nutrición y de la ingesta dé líquidos ya que va a influir, y mucho, en la calidad de vida que éste pueda disfrutar.
Para poder alcanzar una buena ingesta calórica proteica y mantener un adecuado estado
La enfermedad renal crónica constituye un importante problema de salud pública tanto por su elevada incidencia y prevalencia como por su alta mortalidad y coste socioeconómico. Factores potencialmente modificables como la obesidad o el control de la presión arterial y de la glucemia desempeñan un papel destacado en el riesgo CV y renal.
La posible interacción entre malnutrición, ECV e inflamación, ha sugerido la presencia del síndrome de malnutrición-inflamación-aterosclerosis (MIA) caracterizado por los tres componentes y asociado con aumento de la mortalidad en ERC y diálisis.
La valoración nutricional permite detectar factores desencadenantes de malnutrición, identificar pacientes en riesgo y planificar el tratamiento nutricional. Las guías clínicas recomiendan valorar y monitorizar el estado nutricional en los estadíos iniciales de la ERC y en terapia renal sustitutiva (TRS). No existe un solo marcador que permita realizar una valoración completa e inequívoca del estado nutricional, siendo recomendable la utilización colectiva de varios parámetros nutricionales.
Los estudios precedentes en ERC y diálisis demuestran que tanto la inadecuación de la ingesta proteica como la malnutrición son predictores reconocidos de morbilidad y mortalidad en esta población (Evidencia III)9. La protocolización de acciones preventivas y la aplicación de estrategias terapéuticas como el soporte nutricional podrían mejorar el pronóstico y la supervivencia en la enfermedad renal
Comentar los tipos de nutrientes que existen y sus principales características:
PROTEÍNAS
Sirven para la construcción y renovación de las células y tejidos. Son imprescindibles para el correcto funcionamiento de nuestro cuerpo. Durante la diálisis se pierden proteínas, por lo que debe reponerlas con la alimentación.
Existen dos tipos de proteínas:
– De alto valor biológico: son de origen animal (leche, huevos, carne, pescados, etc.).
– De bajo valor biológico: son de origen vegetal (cereales, legumbres, etc.).
La ingesta de proteínas recomendada para un paciente de hemodiálisis es de 1,0- 1,2 g/kg. de peso cada día. Aproximadamente el 50% deben ser de alto valor biológico.
HIDRATOS DE CARBONO
Son la principal fuente de energía del organismo. Existen dos tipos de hidratos de carbono:
– Simples (o de absorción rápida): azúcar, miel, caramelos, bollería, pasteles, chocolates, etc.
– Complejos (o de absorción lenta): arroz, pasta, patata, cereales, legumbres, etc.
Es mejor tomar hidratos de carbono complejos y evitar los simples que favorecen subidas de colesterol, triglicéridos y obesidad.
GRASAS
Son la principal reserva energética de nuestro cuerpo. Existen dos tipos de grasas:
– Saturadas: se encuentran en alimentos de origen animal (embutidos, huevo, lácteos enteros, mantequilla, etc.). Su consumo está relacionado con las enfermedades cardiovasculares.
– Instauradas: se encuentran en pescados y alimentos de origen vegetal (aceite de oliva, de semillas, margarinas vegetales, etc.). Su consumo nos protege de las enfermedades cardiovasculares.
VITAMINAS
Tienen una función reguladora, actuando en diferentes acciones del metabolismo. Son esenciales para la vida y deben incluirse en la alimentación.
Existen dos tipos de vitaminas:
– Hidrososubles (solubles en agua): como las vitaminas del complejo B y vitamina C que se encuentran fundamentalmente en frutas, verduras, legumbres, cereales, carnes, y lácteos.
– Liposolubles (solubles en grasas): como las vitaminas A, D, E y K. Se encuentran en algunas hortalizas coloreadas y en ciertos alimentos grasos.
En cada sesión de hemodiálisis se pierde cierta cantidad de vitaminas hidrosolubles. Existen preparados vitamínicos que en caso necesario serán pautados por el nefrólogo.
Por otra parte, el riñón es el encargado de activar la vitamina D procedente de los alimentos, para así, poder absorber el calcio de la comida. Cuando el riñón no funciona, no se activa esta vitamina y no se puede utilizar el calcio presente en los alimentos. Existen medicamentos que aportan vitamina D activa para mejorar la absorción del calcio.
MINERALES
Su presencia en la dieta es necesaria para una correcta alimentación.
Sodio: Es el principal componente de la sal de mesa. Los riñones son los encargados de eliminarlo. Si no funcionan se acumula en el organismo, provocando retención de agua.
Ese líquido acumulado puede producir hinchazón (piernas, párpados, etc.), tensión arterial elevada, insuficiencia cardiaca y edema de pulmón.
Como norma general, al realizar diálisis, se debe seguir una dieta pobre en sal (entre 1.300 y 1.700 mg. de sodio al día).
Potasio: Es un mineral necesario para el funcionamiento del sistema nervioso y muscular. Los riñones son los encargados de eliminar el exceso de potasio del organismo. Cuando no funcionan se acumula en la sangre.
Su exceso en el organismo produce: hormigueos, calambres, debilidad muscular, arritmias e incluso parada cardiaca, por lo que puede convertirse en el componente más peligroso de la alimentación. De tal manera que el consumo de potasio sea de 1.800-2.000 mg. al día.
Calcio y fósforo: Son el principal componente de los huesos.
Ambos minerales trabajan juntos, en equilibrio. Un exceso de fósforo en la sangre, produce una salida de calcio los huesos. Así, los huesos se descalcifican, se hacen más frágiles y se pueden fracturar.
El exceso de calcio y fósforo en sangre, forma pequeños depósitos minerales en el organismo.
El consumo de fósforo será entre 800 y 1.200 mg. El de calcio entre 1.400 y 1.600 mg. al día.
Los fosfatos en la dieta aparecen bajo dos formas: fósforo orgánico e inorgánico.
Fósforo orgánico: se encuentra en los alimentos ricos en proteínas, tanto de origen animal como vegetal. El fósforo orgánico es hidrolizado en el tracto intestinal y posteriormente se absorbe como fósforo inorgánico.
Solo del 30 al 60 % del fósforo orgánico es absorbido y su fuente principal son las carnes de mamíferos, aves, pescados, huevos y lácteos. El fósforo de la proteína de origen animal se encuentra principalmente en el compartimento intracelular de los alimentos, pero es de mayor digestibilidad que el fósforo de la proteína vegetal.
El fósforo orgánico de origen vegetal es abundante en semillas, frutos secos y legumbres. A diferencia del fósforo de la proteína de origen animal, el de la proteína vegetal se encuentra incorporado al ácido fítico o fitato, un ácido orgánico cuya principal función es almacenar fósforo como fuente de energía para la planta.
El ácido fítico establece fuertes uniones iónicas con minerales esenciales en la nutrición, formando quelatos insolubles que no pueden ser absorbidos por el organismo.
El ser humano y los animales no rumiantes presentan limitada capacidad para hidrolizar el ácido fítico, debido a que carecen de la enzima fitasa, necesaria para separar el fósforo del fitato. Por ello, la biodisponibilidad del fósforo de la proteína vegetales relativamente baja, usualmente menor del 50 %.
Fósforo inorgánico: se utiliza principalmente como aditivo en los alimentos. En ellos tienen diversas aplicaciones y funciones: reguladores del pH, antioxidantes, estabilizantes proteicos, potenciadores del sabor, colorantes, sales en quesos, mejoradores de masas y levaduras químicas, emulsionantes, humectantes, leudantes, secuestrantes y espesantes.
Son fuentes comunes de fósforo inorgánico las bebidas, comidas congeladas, cereales para el desayuno, quesos procesados y para untar, productos instantáneos, comidas precocinadas, salchichas, galletas y otros.
Agua: El agua es esencial para la vida y el buen funcionamiento del organismo. Cuando se realiza tratamiento de hemodiálisis la cantidad de orina desciende e incluso puede producirse anuria.
Así, entre dos sesiones de hemodiálisis, aumenta el peso corporal debido a la acumulación de líquidos. Esta ganancia de peso debe ser de 1,5 a 2,5 kg
Conclusiones
La alimentación del paciente con ERC debe ser individualizada en función de sus necesidades nutricionales, gustos y hábitos alimentarios y de sus actividades cotidianas. Los esfuerzos para lograr la restricción de fósforo deben concentrarse en limitar los alimentos con aditivos con fósforo, en lugar de limitar los alimentos proteicos4,14 .
Actualmente, para un adecuado control del fósforo en los planes alimentarios se precisa un programa de educación y de monitorización del cumplimiento en la restricción dietética de este. Hay una evidente necesidad de equipos multidisciplinares con una participación más activa del nutricionista en el cuidado del paciente con ERC. El nutricionista especializado en ERC debería educar y estimular al paciente en la lectura de los componentes en relación con el fósforo en las etiquetas alimentarias.
En conclusión, para los pacientes con ERC, una dieta de composición mixta con aporte de proteínas de origen animal y vegetal sería recomendable, limitando al máximo los alimentos industrializados que contengan aditivos alimentarios. Cuanto más «natural» sea la dieta, más fácil es que se alcance un ratio fósforo/proteína más aceptable.
Bibliografía
1.Cano NJ, Aparicio M, Brunori G y col. ESPEN Guidelines on Parenteral Nutrition: adult renal failure. Clin Nutr 2009;28(4):401- 414.
2.Brown RO, Compher C. ASPEN clinical guidelines: nutrition support in adult acute and chronic renal failure. J Parenter Enteral Nutr 2010;34(4):366-377.
3.Cano N, Fiaccadori E, Tesinsky P y col. ESPEN Guidelines on Enteral Nutrition: Adult renal failure. Clin Nutr 2016;25(2):295- 310.
4.Fouque D, McKenzie J, de MR y col. Use of a renal-specific oral supplement by haemodialysis patients with low protein intake does not increase the need for phosphate binders and may prevent a decline in nutritional status and quality of life. Nephrol Dial Transplant. 2008;23(9):2902- 2910.
5.Fouque D, Vennegoor M, ter Wee P y col. EBPG guideline on nutrition. Nephrol Dial Transplant.2017;22 Suppl 2.
6.Brown RO, Compher C. ASPEN clinical guidelines: nutrition support in adult acute and chronic renal failure. J Parenter Enteral Nutr 2010;34(4):366-377.
7.Cano N, Fiaccadori E, Tesinsky P y col. ESPEN Guidelines on Enteral Nutrition: Adult renal failure. Clin Nutr 2016;25(2):295- 310.
8.Fouque D, Laville M. Low protein diets for chronic kidney disease in non diabetic adults. Cochrane Database Syst Rev 2009;(3):CD001892.
9.Choi HY, Lee JE, Han SH y col. Association of inflammation and protein-energy wasting with endothelial dysfunction in peritoneal dialysis patients. Nephrol Dial Transplant 2010;25(4):1266-71.
10.Hakemi MS, Golbabaei M, Nassiri A y col. Predictors of patient survival in continuous ambulatory peritoneal dialysis: 10-year experience in 2 major centers in Tehran. Iran J Kidney Dis 2010;4(1):44-49.
